О вакцинах и вакцинации
История вакцинации, антигенная изменчивость и любопытные факты о возбудителях инфекций в изложении профессора молекулярной биологии Георгия Смирнова. Текст будет интересен как для специалистов, так и для тех, кто только начинает путь постижения особенно острой для сегодняшнего времени темы, разделившей общество на два непримиримых лагеря — сторонников и противников прививок.
Автор:
молекулярный биолог Смирнов Георгий
29
минут

Важно!
Этот статья содержит профессиональную специализированную информацию, носит ознакомительный характер и не может расцениваться как призыв к самолечению или принятию решений, находящихся исключительно в компетенции профильного специалиста.
Предисловие автора

Профессор Г.Б. Смирнов
Написать эту работу меня заставили события, происходящие в современном обществе и связанные с пандемией. Люди разделились на два примерно равных по численности лагеря – сторонников и противников вакцинации. Странным образом подобно тому, как пандемия COVID19 охватила весь мир, этот же мир оказался во власти противостояния двух непримиримых когорт, отстаивающих свой взгляд на вакцины. Мне 78 лет. За всю жизнь я никогда не встречал такой массовой убежденности и увлеченности своей идеей, которую мы сейчас наблюдаем в каждом из противостоящих лагерей. Феномен, удивительный по напряженности и массовости. Подозреваю, что социальным психологам будет, чем заняться в ближайшие годы. Раскол не пощадил и семьи – одна из моих дочерей – активный и убежденный персонаж лагеря антиваксеров. Для меня, правда, до сих пор остается загадкой – откуда противники вакцинации черпают свою убежденность. Ведь никаких серьезных научных данных для этого нет. Но создается впечатление, что им такие данные и не нужны – вполне достаточно подтасовок, каких-то извращенных фантазий. Случаются и добросовестные ошибки, и заблуждения. Ведь о вакцинации рассуждают и что-то утверждают и обыватели, и поп-музыканты, т.е. люди, которые неотчетливо представляют себе различия между молекулой и атомом, вирусом и бактерией, бактерией и одноклеточным простейшим.
Например, одной из вопиющих, грубейших ошибок противников вакцинации является их утверждение, что вакцинация способствует ускорению мутаций, приводящих к изменениям spike-белка. Их аргументация: «вирусу хочется выжить, и он стремится избежать атаки антител.» Геном вируса – это полимерная молекула нуклеиновой кислоты, ей не может ничего хотеться, и она не способна ни к чему стремиться. Антропоморфизм здесь совершенно не уместен. Вероятность мутации в популяции прямо пропорциональна численности этой популяции. Например, у бактерий вероятность того, что в каком-то из генов одной особи, произойдет мутация приближается к единице, если общая численность популяции достигнет 108 — 109 особей. Примерно то же у вирусов. То есть для возникновения мутаций вирус должен размножаться, а размножается он очень эффективно как раз в клетках не вакцинированной части населения. Вакцинация резко уменьшает вероятность мутаций вируса. Определенную роль в формировании идеологии антиваксеров играет, конечно, и невежество. Таким образом, отказываясь от вакцинации, человек подвергает риску себя, своих близких, просто окружающих и способствует изменениям вируса, то есть появлению потенциально более опасных форм возбудителя.
Раздел, посвященный механизмам антигенной изменчивости, я написал несколько упрощенным языком, стараясь ни в коем случае не искажать известные научные факты. Однако этот раздел потребует от читателя, не знакомого с основами молекулярной биологии, даже не напряжения, а просто определенной сосредоточенности. Я убежден, что человек, освоивший эту часть будет вознагражден ощущением приобщения к изяществу и изысканной красоте мира жизни.
Г.Б. Смирнов
профессор молекулярной биологии
член-корреспондент РАН
О вакцинах и вакцинации
«Лучше предупреждать болезнь,
чем лечить ее»
У. Черчилль (Фултоновская речь)
Кажется, его фамилия была Нейбауэр. Он инвалид, немного старше меня, передвигается на двух костылях. 1966 год. Мы сидим на скамейке рядом с биологическим корпусом МГУ и обсуждаем последние работы по восстановлению ДНК от повреждений, вызванных ультрафиолетом. Последние – они же первые – эта область науки только рождается. Обсуждаем – это не совсем точно. Он рассказывает, а я слушаю. Я только что окончил медицинский институт и приехал из Ставрополя в Москву специально, чтобы попасть на Международный микробиологический конгресс. Президент конгресса – В.Д. Тимаков. Я у него уже был примерно год назад, в прошлый приезд в Москву. Сказал, что хочу заниматься генетикой бактерий, показал свой обзор на тему «Пол и генетика бактерий», который докладывал на студенческом кружке в Ставрополе. Владимир Дмитриевич отнесся ко мне благосклонно, спросил, на каком я курсе и, узнав, что я заканчиваю обучение через год, сказал: «Вот через год и приезжай. Пойдешь в аспирантуру к Скавронской». Я приехал немного раньше, попросил у него гостевой билет на конгресс, который мне был незамедлительно выдан. К Аделине Генриховне Скавронской я тоже зашел и узнал, что она хочет начать работу в новом направлении, которое обозначила как «репаир системс». Имелось ввиду repair systems. Что это значит, я понятия не имел. Попав на конгресс, я не обнаружил устных докладов по этой тематике, но наткнулся на тезисы, где речь шла как раз о репарации. Автором тезисов был некто Нейбауэр. Как-то я его нашел. Этот молодой парень сразу понял, что мои познания в области репарации ДНК равны нулю и не стал рассказывать мне о своей экспериментальной работе, а начал просвещать. Я узнал, какие именно лаборатории и в каких странах занимаются этой тематикой, что именно известно и что не известно на настоящий момент. Чувствовалось, что человек этим увлечен и только этим живет. Да и чем еще он мог жить, с трудом передвигаясь на костылях! Так я впервые столкнулся с последствиями полиомиелита. Что касается нашей беседы, то она мне очень помогла. За короткое время перед началом работы в аспирантуре я прочел довольно много статей по репарации и приступил к работе у А.Г. Скавронской, на тот момент неплохо ориентируясь в проблеме.
Второй раз я встретился с человеком, переболевшим полиомиелитом, в Германии. Это было уже в середине 70-х. Вместе с ним и его подругой мы предприняли автомобильное путешествие из Вернигероде в северную Тюрингию. Там осмотрели мемориал Фридриху Барбароссе. Был такой могучий правитель у немцев в середине 12 века. Участвовал в 3 крестовом походе. Нашего гида звали Йорг, и он был сотрудником вернигеродского института. Тоже инвалид, тоже на костылях. Позже Йорг Хакер перебрался в Вюрцбург, где стал директором крупного института, а еще позже членом и даже президентом Леопольдины – немецкой национальной академии наук. В дороге его подруга, симпатичная молодая фройляйн Ева (немцы произносят Ифа), которая вела машину, время от времени переходила на неформальную лексику, я так и не понял, почему.
Смертность при полиомиелите не столь высока, как при многих других инфекционных заболеваниях, однако, его последствия чрезвычайно серьезны. Никому не удалось подсчитать, сколько инвалидов оставила после себя эта болезнь за всю историю человечества. Важно еще и то, что, поражая человека в детском возрасте, вирус оставляет его калекой на всю жизнь. Не избежал печальной участи и один из лучших президентов США Франклин Рузвельт. Вакцины против полиомиелита – инактивированная Д. Солка и живая А. Сэбина были созданы в 50-е годы и, благодаря усилиям М.Чумакова и А. Смородинцева, живая вакцина стала широко применяться в нашей стране и в мире с начала 60-х. Двое, встретившихся мне молодых ученых, стали инвалидами, так как родились немного раньше того времени, когда полиовакцина попала в календарь детских прививок. Теперь в развитых странах полиомиелита нет. По официальным данным в настоящее время отдельные случаи полиомиелита наблюдаются только в Афганистане и Пакистане. Вакцинация сделала свое дело, однако, анализ очень редких случаев полиомиелита, вызванных вирусом вакцинного происхождения, в последние годы показал, что необходима работа по созданию новой современной вакцины.
Благодаря вакцинам резко сократилась или вовсе исчезла опасность заболеть многими инфекционными болезнями. И это важнейшее достижение медицинской микробиологии. А начиналось все в 18 веке, в самом его конце. Считается, что первым человеком, создавшим и применившим вакцину, был английский врач Эдвард Дженнер, а первым успешно привитым 8-летний мальчик Джеймс Фиппс. Это не очень точно. Дело в том, что упомянутый случай был первым задокументированным, хотя и до Дженнера другие врачи вакцинировали других мальчиков и тоже успешно. Речь идет о вакцинации против оспы. В те времена оспа (натуральная или черная оспа) была очень распространенной, тяжелой болезнью. Смертность при оспе достигала 30%, а при геморрагической форме 75-100%. При этом вирус оспы обладает фантастической контагиозностью. Человек мог заразиться, проходя мимо приоткрытой двери, за которой находился больной. Были и гораздо более впечатляющие примеры. В Советском Союзе проводились очень широкие исследования особо опасных инфекций. Большинство из них были засекречены, многие выполнялись военными. [Нужно сразу поставить точки над и – такое положение вещей не было чем-то характерным только для Советского Союза. Секретные бактериологические лаборатории на протяжении десятков лет работали и продолжают работать в Форт Детрике (США), Портон-Дауне (Великобритания), в Японии и некоторых других странах. Более того, после распада СССР США организовали такие лаборатории в бывших Советских республиках (Казахстане, Грузии, Украине).] Так, в СССР до Великой Отечественной войны на острове озера Селигер работала лаборатория ПНИЛ-52. В начале войны она была переведена в Киров, потом в Саратов, а в 1942 году оказалась на острове Возрождения в Аральском море. Здесь лаборатория была существенно расширена и превратилась в полигон под названием «Бархан». В течение нескольких десятилетий (до 1992 года) на полигоне проводились испытания бактериологического оружия с использованием подопытных животных (собаки, обезьяны, крысы, лошади, овцы). Работали с возбудителями сибирской язвы, чумы, туляремии, бруцеллеза и оспы. Именно с оспой связаны легендарные истории (документы по понятным причинам недоступны), о которых есть информация в художественной литературе (А. Комиссаренко «Чумной остров»). Автор пишет, что в 1971 году некое судно, выполнявшее экологические исследования подошло близко к острову, на котором в это время проводились испытания препарата на основе вируса оспы. Аэрозоль достиг корабля и заразил находящихся там людей. Вернувшись в город, экологи заразили нескольких жителей, которые скончались. По другой версии этого эпизода корабля не понадобилось – вирусы оспы по воздуху преодолели расстояние от острова до городка Аральск, многие жители были заражены и погибли. Так что в исключительной контагиозности оспы сомневаться не приходится.
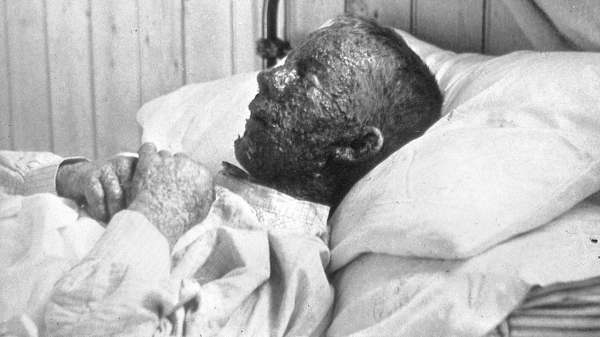
Больной натуральной оспой. Copyright: Wellcome Collection (Public Domain)
https://wellcomecollection.org/works/y2xgarem/items
Вакцинация, примененная Дженнером и его предшественниками, была основана на наблюдении, что натуральной оспой не болеют сельскохозяйственные рабочие (фермеры), общавшиеся с коровами, больными коровьей оспой. Заражение (вакцинация) материалом пустул коровьей оспы предотвращало заболевание оспой натуральной.
Россию оспа тоже не пощадила. Вероятно, власти были вынуждены обратить серьезное внимание на проблему, когда в 1730 году от оспы умер 15-летний император Петр II. В Россию немедленно пригласили английского специалиста Томаса Димсдейла, который сделал прививку против оспы Екатерине II и наследнику престола Павлу Петровичу. Массовая вакцинация в России началась торжественно. В 1801 году, в помещении Императорского Воспитательного дома в Москве доктор Мухин в присутствии коллег и знати привил мальчика, которого звали Антон Петров. Вакцинация была успешной и Антону Петрову поменяли фамилию. С этого момента он стал Антоном Вакциновым. Интересно, сохранилась ли фамилия до наших дней?
Применение оспенной вакцины по всему миру имело огромный успех. Считается, что последний случай заражения черной оспой в естественных условиях произошел в 1977 году. Однако в 1978 году в Англии, в Бирмингеме заразилась и умерла женщина, медицинский фотограф Джанет Паркер, которая работала в отделе анатомии Бирмингемской медицинской школы. Скорее всего, это было все-таки лабораторное заражение. В 1980 году ВОЗ торжественно объявила о тотальной ликвидации оспы. Референс-штаммы сохранили. Они находятся в двух лабораториях: у нас – в Кольцово под Новосибирском и в CDC (Centers for Disease Control) – в Атланте. Очень хорошо, что сохранили – это позволило, когда появилась возможность, сиквенировать (прочитать) геном вируса. Сиквенирование провели одновременно в обеих лабораториях – в Кольцово и в Атланте. Оказалось, что геном вируса оспы состоит из 200 генов. Это много, нетипично много для вируса, но согласуется с тем фактом, что геном этого вируса, в отличие от других ДНК-содержащих вирусов, реплицируется в цитоплазме, независимо от клеточного ядра. То есть, геном кодирует все белки, необходимые для собственной репликации и сборки частиц. В настоящее время изучены функции далеко не всех белков вируса оспы. Очевидно, что это необходимо сделать, в частности, для того, чтобы, заботясь о будущем, сконструировать современную противооспенную вакцину. Ведь этот, не до конца изученный вирус, за последние 100 лет перед ликвидацией болезни унес по разным оценкам от 300 до 500 млн жизней – больше, чем все войны, вместе взятые, и пренебрегать угрозой новых эпидемий оспы ни в коем случае нельзя.
Огромный вклад в вакцинологию (как, впрочем, и в другие разделы микробиологии) внес великий француз – Луи Пастер.

Луи Пастер. Copyright: Луи Пастер. Фото: Wellcome Collection (Public Domain) https://wellcomecollection.org/works/wmzg654t/images?id=h833bwar
Предполагается, что стимулом для начала его микробиологических исследований стала смерть трех его дочерей от брюшного тифа. Работая с возбудителями куриной холеры, Пастер обнаружил, что старая ослабленная микробная культура не вызывала тяжелой болезни цыплят. Более того, если цыплят, которым ранее вводили старую культуру, заразить свежей культурой, то они не заболевали и не погибали. В память о Дженнере и в его честь Пастер назвал процедуру прививки вакцинацией (от латинского vacca – корова). Мы помним, что Дженнер прививал людям коровью оспу. Так, что термин «вакцина» ввел в обиход Луи Пастер. Его следующим достижением было создание вакцин против бешенства и сибирской язвы.
Возбудителем бешенства является РНК-содержащий вирус. Чаще всего человек заражается после укуса бешеным животным. В 1880 году Пастер наблюдал смерть 5-летней девочки, укушенной бешеной собакой. Полученные впечатления заставили его серьезно заняться работой над антирабической (rabies – бешенство) вакциной. Нужно помнить, что в то время еще никто ничего не знал о вирусах, их не могли ни видеть, ни культивировать. Трудно себе представить, как именно думал Пастер, когда планировал эксперименты по созданию этой вакцины. У него была единственная возможность – использовать свой собственный опыт работы с куриной холерой, и он этим опытом воспользовался. Видимо, исходя из симптомов бешенства, Пастер предположил, что болезнь поражает мозг. Поэтому он последовательно пассировал ткани мозга больного кролика, заражая ими здоровых животных. На определенном этапе мозговую ткань больного (или умершего) животного высушивали в течение 2 недель. Этим ослабляли вирулентность неизвестного болезнетворного начала. Такой материал и был использован в качестве прививочного. Сначала на кроликах, потом на собаках. Процедура помогала – привитые собаки, покусанные бешеными сородичами, даже не заболевали. Пастер не был врачом и не имел права делать какие-либо прививки людям. Но когда ему привезли мальчика, покусанного бешеной собакой, он решил рискнуть. 9-летнего Йозефа Майстера, семья которого жила в Эльзасе, покусала бешеная собака, и его отец, слышавший об экспериментах Пастера, настоял, чтобы мать отвезла ребенка в Париж, к знаменитому «доктору». Тогда люди уже хорошо знали, что последствия бешенства фатальны. Пастер сделал прививку, и Йозеф был спасен. Это был первый случай вакцинации человека от бешенства. Шел 1885 год. До открытия вирусов оставалось еще 7 лет. К Пастеру началось паломничество людей, покусанных бешеными животными. Приезжали не только французы, но и жители других стран. Эта заслуженная известность обернулась печальной, можно сказать трагической стороной. Очень многие обращались за помощью слишком поздно – через 2, 3 и более недель после заражения. За это время вирус успевал добраться до центральной нервной системы, и помочь таким больным было уже невозможно. Люди умирали. Завистники и просто невежественные обыватели стали называть Пастера убийцей. В 1887 году на заседании Коллегии медицины Пастер был обвинен в том, что он попросту убивает людей кусочками мозга зараженных кроликов. У ученого случился второй инсульт, отнялись рука и нога. В этом состоянии Пастер провел остаток жизни. Он скончался 28 сентября 1895 года.
В 20 веке, особенно в его последней трети, благодаря бурному развитию науки возможности для конструирования вакцин многократно увеличились.
К настоящему времени созданы и применяются десятки различных вакцин. Только в России производится 40 вакцин.
Задачей вакцинации является представление иммунной системе человека или животного протективного антигена возбудителя. Термином протективный обозначается антиген, в ответ на поступление которого в макроорганизм, вырабатываются антитела и происходят другие иммунные реакции, которые защищают его от фатальных последствий инфекции, вызванной природным возбудителем. Такой протективный антиген может находиться в составе целых инактивированных бактериальных клеток или вирусных частиц (инактивированные вакцины). Бактерии могут быть живыми, но тем или иным способом лишенными вирулентности, то есть неспособными вызывать болезнь (живые вакцины). Вакцина может вовсе не содержать целых клеток или вирусов, а состоять из их частей, включающих нужный антиген (химические вакцины). Есть вакцины, в которых объединены антигены разных возбудителей (поливалентные вакцины). Наконец, есть вакцины, в состав которых входят даже не антигены, а генетические детерминанты, их кодирующие (ДНК-вакцины и РНК-вакцины). Казалось бы, проблемы вакцинации решены, остается только применить подходящий способ представления протективного антигена иммунной системе. Однако так только казалось.
Выяснилось, что некоторые возбудители инфекций обладают свойством, которое было названо антигенной изменчивостью. Это значит, что они могут менять состав антигенов. Возбудитель попадает в макроорганизм, иммунная система которого формирует ответ на его антиген(ы), а возбудитель перестает синтезировать эти «засвеченные» антигены и начинает синтезировать новые, с которыми иммунная система еще не знакома. Возбудитель получает время для продолжения размножения. Болезнь беспрепятственно прогрессирует. У разных возбудителей антигенная изменчивость выражена в различной степени. Иногда взаимозаменяются всего два антигена. А в некоторых случаях – это сложная программа, оперирующая десятками или даже многими сотнями антигенов. Здесь никакая вакцина не может помочь в принципе. Искусством «обмана» иммунной системы в совершенстве овладели нейссерии (возбудители гонореи), боррелии (возбудители возвратного и эндемического возвратного тифа, и болезни Лайма), и некоторые одноклеточные простейшие – возбудители сонной болезни и малярии. В связи с этим, стоит вспомнить, что до сих пор нет даже кандидатов на вакцины против перечисленных инфекционных агентов, нет эффективной вакцины против малярии, вспомнить и задуматься.
Кроме репертуара антигенов очень серьезным фактором антигенной изменчивости является скорость антигенных замен. Следует отметить, что механизмы таких замен могут быть совершенно разными. Так, геномы некоторых вирусов состоят из отдельных сегментов. Хорошо изученным примером является РНК-содержащий вирус гриппа. Сегменты генома этого вируса могут заменять друг друга в ходе его циркуляции в природе (в клетках), образуя разнообразные сочетания. Этот процесс называется реассортациями. В ходе реассортаций возникают различные комбинации антигенов Н (гемагглютинин) и N (нейраминидаза), которые и положены в основу классификации эпидемических штаммов вируса гриппа. Хотя считается, что вирус гриппа обладает очень высокой степенью изменчивости, тот или иной эпидемический вариант (реассортант) обычно циркулирует в течение сезона. Это позволяет приготовить вакцину, действующую по меньшей мере один сезон.
Совсем другое дело, если антигены меняются в течение одного инфекционного цикла. Здесь все определяется особенностями организации и строения генов, кодирующих соответствующие антигены. Рассмотрим, какие механизмы используют для смены антигенов некоторые бактерии и одноклеточные простейшие. Начнем с возбудителя гонореи — гонококка — Neisseria gonorrhoeae. Основной поверхностный антиген нейссерий – белок ворсинок пилин. Ворсинки (пили) определяют способность бактерий прикрепляться к определенному типу эпителиальных клеток, т.е. определяют специфичность адгезии. Смена генов пилина в процессе инфекции называется антигенными вариациями.
Имеется всего два типа генов пилина:
1. Экспрессирующиеся гены pilE1и pilE2 и
2. Молчащие гены pilS, представленные в хромосоме в большом количестве. Эти гены лишены 5′ части, кодирующей аминотерминальную последовательность белка пилина.
Дефектные гены pilS сгруппированы в кассеты, по 6 генов и более.
Схема строения гена пилина N. gonorhoeae
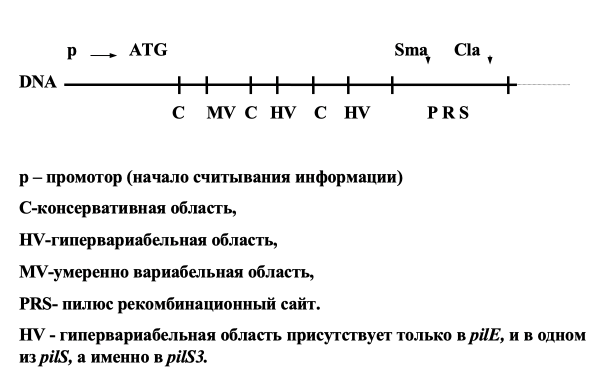
Механизм антигенных вариаций состоит в следующем.
В HV области pilS накапливаются мутационные изменения. Важно помнить, что для мутационного процесса в генах pilS нет никаких ограничений со стороны естественного отбора, поскольку эти гены не экспрессируются. Между генами pilE и pilS происходит нереципрокная RecA-зависимая рекомбинация, которая использует для кроссинговера PRS сайт и проксимальную область MV. При этом естественным отбором отвергаются только те мутации HV области, которые препятствуют сборке пилей. Дополнительным источником разнообразия являются рекомбинационные события между молчащими генами pilS.
Антигенные вариации пилина не только позволяют бактериям очень эффективно уходить от атак иммунной системы, но и дают им возможность адсорбироваться на различных типах слизистых оболочек.
Клинические иммуннологические исследования в полной мере соответствуют представлениям об активной антигенной изменчивости нейссерий, проявляющейся в ходе конкретного заболевания. Это делает понятным и отсутствие иммунитета у переболевших гонорреей и огромные трудности в конструировании вакцины.
Наряду с антигенными вариациями у нейссерий существует еще один тип антигенной изменчивости, который называется фазовые вариации. Перед тем, как перейти к рассмотрению его механизма, желательно вспомнить особенности генетического кода. Генетический код, используемый всеми живыми объектами на Земле, является четырехбуквенным и триплетным, то есть считывается определенными тройками букв-символов. Каждая тройка нуклеотидов нуклеиновой кислоты кодирует одну аминокислоту белка. Чтобы текст читался правильно, считывание нужно начинать с определенной точки. Она называется стартовый кодон. Если старт сдвинут, тройки будут неправильными и ничего не будут обозначать (кодировать). Такая ошибка называется сдвиг рамки считывания.
Итак, фазовые вариации нейссерий затрагивают второй поверхностный антиген — мембранный белок pII или Ора , который участвует в адгезии возбудителя к слизистой. Его наличие придает колониям мутность, а отсутствие — прозрачность. Переходы от Ора+ к Ора- и обратно происходят с частотой 10-3 в популяции одного штамма. Это и есть фазовые вариации. Оказалось, что в хромосоме имеется 9 копий отличающихся друг от друга генов ора, все они экспрессируются, однако, в мембране обнаруживается только один тип белка, то есть продукт только одного из 9 генов. Причина этого явления состоит в том, что после промотора (сайт инициации транскрипции) гена ораЕ идет инициирющий кодон и сигнальная последовательность, содержащая несколько тандемных повторов СТСТТ. После тандемных повторов (TR-tandem repeats) идет последовательность, кодирующая сам зрелый пептид Ора. Количество этих TR вариабельно и различается в девяти имеющихся генах. Для попадания в правильную рамку считывания необходимо иметь строго определенное количество TR (кратное трем, например). Правильную рамку считывания в каждой клетке имеет только один ораЕ ген из 9. Изменение количества TR приводит к исчезновению продукта, который раньше был представлен в мембране и появлению нового антигена Ора.
Схема строения гена антигена opa
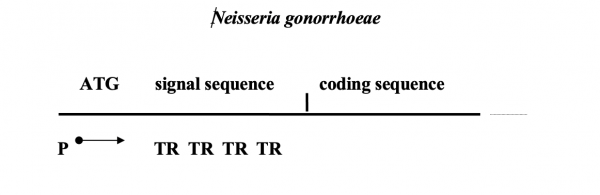
Такую же схему реализуют два других возбудителя: Mycoplasma genitalium (возбудитель ЗППП) и Haemophilus influenza (возбудитель менингитов и пневмоний). У последнего из них обнаружено 9 генов, содержащих в своей проксимальной области короткие TR, представленные тетрануклеотидами.
Точный механизм регуляции количества TR пока неизвестен. Данный пример антигенной изменчивости не связан с перестройками кодирующих последовательностей структурных генов антигенов или перемещением полноценных генов. Вместо этого изменяется количество коротких, ничего не кодирующих повторов, расположенных перед смысловой кодирующей последовательностью. Какие факторы управляют этим процессом и как они это делают – совершенно не известно.
Рассмотрим, что имеет место в случае боррелий.
Боррелии содержат два типа плазмид: несколько однокопийных и одну мультикопийную (28 тнп – тысяч нуклеотидных пар). Однокопийные плазмиды содержат большое количество не экспрессирующихся, но в остальном, полноценных генов, кодирующих структуру антигена VMP. Мультикопийная плазмида имеет один экспрессирующийся ген vmp. Плазмиды боррелий линейны. Это означает, что для рекомбинации достаточно одного перекреста. В молчащих генах однокопийных плазмид накапливаются мутационные изменения. Рекомбинация между молчащими копиями и экспрессирующимся геном приводит к возникновению новых антигенов.
Другим, интенсивно изучаемым в последние примерно 3 десятилетия объектом, является возбудитель болезни Лайма – Borrelia burgdorferi, которая тоже меняет свои поверхностные антигены. В плазмиде этой спирохеты находятся одна экспрессирующаяся (vlsЕ) и 15 «молчащих» копий кассет с геном основного поверхностного липопротеина VLS. В генах vls есть 6 консервативных и 6 высоковариабельных областей; последние, вероятно, и определяют разнообразие антигенного репертуара. Как экспрессирующаяся, так и «молчащие» копии vls фланкированы прямыми повторами консервативных 17-членных последовательностей TGAGGGGGCTATTAAGG. После инфекции индуцируется механизм рекомбинационного обмена между экспрессирующейся и «молчащими» копиями vls. 17-членные последовательности, скорее всего, распознаются рекомбиназами, которые осуществляют замещение фрагментов гена vlsЕ на гомологичные, но не идентичные участки ранее не экспрессировавшихся копий vls. Так происходит постоянная смена эпитопов поверхностных антигенов боррелий в организме теплокровного хозяина. Генетический механизм смены антигенов у возбудителя болезни Лайма очень похож на таковой, свойственный смене Pil-антигена возбудителя гонореи, и в этом примере не было бы ничего удивительного, если бы не ограничение генных кассет прямыми повторами 17-членных последовательностей. Все-таки, обычно, прямые повторы способствуют удалению из генома заключенного между ними участка ДНК. В данном случае справедливо обратное – неэкспрессирующиеся копии генов vlsсохраняются в геноме плазмиды, несмотря на то, что они ограничены прямыми повторами, то есть вопреки закону генетики.
Tripanosoma brucei — возбудитель сонной болезни
В отличие от ранее рассмотренных возбудителей, это не бактерии, а одноклеточные простейшие. Как же меняют свой антигенный состав трипаносомы? У трипаносом гены, кодирующие поверхностный доминантный антиген — VSG (Variant Surface Glycoprotein), локализованы в 20 теломерах (теломеры – концевые участки хромосом, состоящие из коротких видоспецифических прямых тандемных повторов). Этот антиген присутствует в количестве 15 миллионов молекул на каждую клетку. Из 20 возможных сайтов экспрессии работает только один (сайт ELC). В нем экспрессируются несколько копий гена, кодирующего VSG. Есть и несколько сотен молчащих копий гена VSG, которые соответственно, не экспрессируются (сайт BC).
После укуса мухи це-це в организме позвоночного с частотой около 10-3 на клетку на генерацию происходит смена VSG. Смена обеспечивается за счет рекомбинации между экспрессирующейся копией гена и одним из многих сотен молчащих гомологичных, но не идентичных аллелей. Очень интересно еще и то что, согласно более поздним данным, молчащая копия гена VSG переносится в сайт экспрессии не сама по себе, а в составе группы (примерно из 6) генов. Одним из генов этой группы является ген рецептора белка трансферина. Этот рецептор обеспечивает способность трипаносом связывать нагруженный ионами железа трансферин теплокровного хозяина. Смена рецептора означает появление способности связывать иной трансферин и, следовательно, выживать, если предыдущий трансферин приносил недостаточно ионов железа. Вся группа генов переносится в сайт экспрессии с частотой максимум 10-3. Таким образом, имеет место реализация некой программы, направленной на появление в популяции фракции, экспрессирующей рецептор альтернативного трансферина. В том случае, если предыдущий трансферин исчез (смена хозяина) или стал неэффективным, появление нового рецептора позволит фракции, им располагающей, выжить. На мой взгляд, здесь наблюдается реализация программы преадаптации к возможным изменениям среды обитания, а не фенотипического отбора. Итак, каждая клетка трипаносом содержит около 1000 неэкспрессирующихся гомологичных генов VSG (и какое-то количество генов рецепторов трансферина), которые не были удалены как ненужные. Они, на самом деле, и не являются ненужными, так как выполняют очень полезную функцию – обеспечивают смену антигенов и рецепторов трансферина для ухода от действия иммунной системы и возможности утилизации ионов железа при смене условий существования.
Молекулярный механизм антигенной изменчивости в данном случае сводится не к рекомбинации, приводящей к замещению части гена, как это имеет место в случае pil генов у возбудителя гонореи или при смене поверхностного липопротеина VLS у Borrelia burgdorferi, а к транспозиции полноразмерных генов из сайтов ВС в сайт ELC. Это несколько необычная транспозиция. В отличие от классической, при транспозиции у трипаносом последовательности на концах транслоцируемого фрагмента не всегда одни и те же. Интересно, что скорость накопления мутационных изменений в ВС копиях не везде одна и та же, а зависит от локализации конкретной ВС копии на хромосоме.
Очень важна и программа смены антигенов, то есть последовательность транслокаций ВС копий, количество которых (как мы уже говорили) приближается к 1000, а частота транслокаций составляет около 10-4 – 10-3. В селекции новых типов антигенов принимает участие иммунная система. Эта последовательность не абсолютно беспорядочна, но и не является жесткой. Именно такая программа не оставляет иммунной системе хозяина никаких шансов на успех в борьбе с возбудителем. Интересно, что если выделить возбудитель на хронической стадии болезни и ввести его в здоровый организм, то в новом хозяине он начнет проигрывать программу с исходной точки, подобно перемотанной назад кассете, тогда как в прежнем – он будет продолжать реализовывать репертуар антигенов.
Антигенная изменчивость возбудителя малярии
Существует несколько видов малярийных плазмодиев PI. vivax, PI. falciparum, PI. ovale и PI. malariae. Наиболее опасный для человека вид возбудителя малярии – Plasmodium falciparum. Как и трипаносомы, плазмодии не прокариоты, а одноклеточные простейшие. На разных этапах инфекции плазмодии размножаются и в тканях макроорганизма (тканевой цикл), и в крови (эритроцитарный цикл), используя как деление, так и половой путь размножения. Здесь мы не будем останавливаться на этих важнейших деталях.
Механизм антигенной изменчивости плазмодиев принципиально отличается от рассмотренных ранее. Здесь не происходит ни рекомбинаций между копиями генов, ни перемещения гомологичных генов в активный сайт, ни изменений в сигнальной последовательности. Малярийные плазмодии не имеют набора гомологичных генов, кодирующих поверхностные антигены. Ген для каждого из антигенов представлен в единственном экземпляре. Однако без повторов обойтись все-таки нельзя. Повторы коротких гомологичных последовательностей находятся внутри кодирующей части генов. Повторы имеют различную протяженность – от 24 до 45 нп и представлены различным количеством копий – от единиц до 100. Повторы разной протяженности частично гомологичны, но некоторые группы повторов считываются в разных рамках. Молекулярные механизмы изменчивости генов, кодирующих антигены плазмодиев, до конца не изучены, но очевидно, что они связаны с преобразованиями, зависящими от повторов в центральных частях генов. У разных штаммов и, естественно, у разных видов плазмодиев типы повторов и их количество отличаются.
Схема организации гена S-антигена P. falciparum
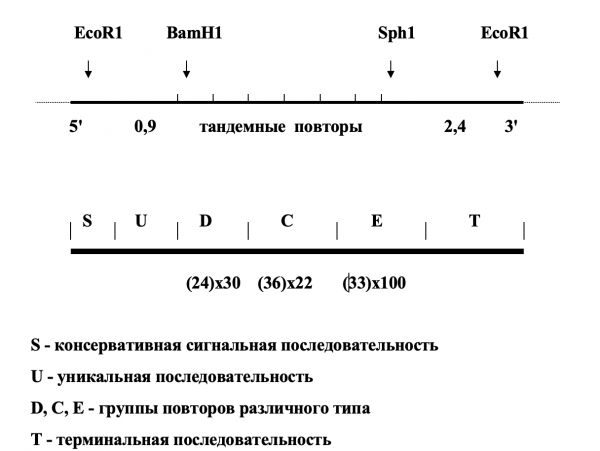
Важно сказать еще об одном принципиальном отличии. Новые антигенные варианты плазмодиев не селекционируются антителами, как это имеет место в случае трипаносом. Смена антигенов происходит у большей части популяции, когда еще не успели образоваться антитела к предшествующему антигену. Это подтверждено и в лабораторных экспериментах, в которых селектирующее действие антител было исключено. То есть ни о каком естественном отборе в данном случае речь не идет – антигены и кодирующие их гены меняются в соответствии с внутренней жесткой программой. Более того, каждый штамм имеет свою собственную программу смены антигенов.
Таким образом, различные возбудители используют различные механизмы для создания антигенного разнообразия и смены антигенов в ходе инфекционного процесса. Это избирательная экспрессия, не сопровождающаяся рекомбинацией внутри структурного гена (opa-гены нейссерий), рекомбинация в определенных участках структурных генов, приводящая к обмену частей генов (pilE-гены нейссерий), одиночный кроссинговер линейных плазмид боррелий, транспозиция целого полноценного гена VSGу трипаносом. У плазмодиев весь механизм антигенной изменчивости умещается в пределах одного гена. Различны и программы смены антигенов – от полностью беспорядочной до абсолютно жесткой. Совершенно очевидно, что каким бы ни был молекулярный механизм смены антигенов, процесс антигенной изменчивости резко снижает эффективность иммунной реакции макроорганизма и ставит под сомнение успешность иммунопрофилактики некоторых инфекций.
Начиная с 1975 года, почти 30 лет я руководил одной из лабораторий института эпидемиологии и микробиологии им. Н.Ф. Гамалеи АМН СССР. В 80-е годы мы активно сотрудничали с саратовским противочумным институтом «Микроб». Предметом сотрудничества была генетика холерного вибриона. Исследования развивались успешно, были получены интересные и значимые результаты, но нас особенно увлекала работа по конструированию противохолерной вакцины. На тот момент вакцина существовала, но она ни в коем случае не соответствовала представлениям о патогенезе заболевания и механизмах иммунитета. Как мы тогда говорили об этом между собой – кололи не то и не туда. Мы были убеждены в том, что вакцина должна быть живой и пероральной. Ее и конструировали. Для нас было очевидно, что иммунитет при угрозе заражения должен быть антитоксическим, то есть антитела должны инактивировать холерный токсин. Было решено конструировать генно-инженерную вакцину. Холерный токсин состоит из 2 субъединиц А и В. Субъединица А отвечает за токсичность молекулы, а субъединица В – за иммунность, то есть является протективным антигеном. Соответственно, ген, кодирующий токсин, также состоит из двух частей, которые обозначаются ctxA и ctxB. У холерного вибриона ген ctxAB локализован в одной из хромосом. Почти точно такой же ген (eltAB) может входить в состав плазмиды, которая часто присутствует в бактериях кишечной палочки (E. coli). Такая кишечная палочка называется энтеротоксигенной и вызывает заболевание, которое по клинической картине не отличается от холеры. Мы клонировали ген eltB и поместили его в векторную плазмиду, которую ввели в подходящий штамм E. coli. После этого эти же бактерии снабдили геном, который позволял им прикрепляться к эпителию кишечника человека. Существуют аналогичные гены, для адгезии на эпителий кишечника свиней и телят. С ними мы тоже работали. Все эти исследования проводили совместно с институтом «Микроб», где ими руководила Нина Ивановна Смирнова. Лидером нашей группы был Владимир Леонидович Мотин. Поскольку белки В-субъединиц, кодируемых генами ctxB и eltB, почти идентичны, наш потенциально вакцинный штамм прекрасно защищал лабораторных животных от холеры, т.е. лабораторные испытания прошли очень успешно. На очереди были доклинические и клинические испытания, которые требовали весьма ощутимых финансовых затрат. Но начались 90-е и о продолжении работы пришлось забыть. Владимир Мотин уехал в США, где в лаборатории Р.Р. Брубакера, в Мичиганском университете занялся работой над созданием современной вакцины против чумы. В настоящее время он профессор университета штата Техас.
Сейчас в качестве векторов часто используются вирусные геномы. Есть векторные вакцины на С момента наших работ над вакциной против холеры прошло много времени. Технологии разработки векторных вакцин быстро совершенствовались. Векторы были необходимы для доставки нужного антигена к клеткам и тканям вакцинируемого организмаоснове аденовирусов, вирусов кори, гриппа, везикулярного стоматита. Например, аденовирусная платформа, которая была использована для конструирования Спутника V, успешно применялась раньше для создания вакцин против, вируса ближневосточного респираторного синдрома (MERS), лихорадки Эбола лихорадки Ласса и других. Так что сетования современных противников вакцинации относительно того, что вакцина не проверена, сделана скоропалительно и «на коленке», не соответствуют действительности. Основные этапы конструирования вакцины состоят в следующем. Из генома вируса удаляют ранние гены из областей Е1 и Е3. Это лишает вирус способности размножаться в клетках. Однако способность генома проникать в клетки сохраняется. Затем на место гена Е1 вставляется ген, кодирующий антиген, против которого должны быть выработаны антитела — в случае Спутника V это ген, кодирующий spike-белок коронавируса. Мы получаем генно-инженерную конструкцию, которая может проникать в клетку, неспособна в ней размножаться, но способна индуцировать выработку антител против коронавируса. Мы видим, что создание такой вакцины потребовало от разработчиков тщательного изучения природы и аденовируса, и коронавируса, разработки технологии манипуляций геномами и возможности использования этих знаний и опыта на практике. Учитывая сказанное попытки представить Спутник V как недоработанную, опасную вакцину напоминают аргументы противников вакцинации времен Дженнера или Пастера, которые призывали не вакцинироваться, поскольку процедура может превратить привившихся в корову.
Сейчас, когда благодаря успехам молекулярной биологии стали очевидными невероятная сложность генетической организации возбудителей опаснейших инфекций и изощренная стратегия их «поведения» в инфицированном организме, нельзя не восхищаться мужеством и талантом первооткрывателей, обладавших весьма ограниченными по современным меркам знаниями в этой области. Вакцинопрофилактика чумы имеет богатейшую историю. Пожалуй, первые эксперименты в этой области были проведены еще в конце 18 века русским ученым Данилой Самойловичем Сушковским (Самойлович). Однако их вряд ли можно считать успешными. Массовые и вполне успешные опыты использования разработанных им самим вакцин против холеры и чумы были осуществлены учеником Ильи Ильича Мечникова Владимиром Ароновичем Хавкиным (Мордехай-Вольф Хавкин). Личность и биография этого замечательного человека вполне могли бы послужить материалом для написания увлекательного романа.

Владимир Хавкин. Copyright: Wellcome Collection (Public Domain) https://wellcomecollection.org/works/as9gafvt/images?id=rjtvw99x
Во время пребывания в Индии Владимир Аронович в 1893 году испытывал свою вакцину против холеры, которая в то время уносила миллионы жизней. Вакцина демонстрировала прекрасные результаты. Однако в самом начале компании по вакцинации к лаборатории Хавкина прибыла толпа индусов с палками с намерением разгромить лабораторию и убить ученого. Они не понимали разницы между профилактикой и лечением и были возмущены тем, что прививки получают только здоровые люди, а больным доктор не помогает. Заболевшим вакцина, действительно не помогала. Хавкин вышел к ним, снял рубашку и вколол себе вакцину. Убивать не стали. Решили сами привиться. Эпидемия холеры была остановлена. Через 3 года Хавкин начал испытания вакцины против чумы, которая тогда тоже свирепствовала в Индии. Сначала вакцину испытали на заключенных тюрьмы Бикула. В качестве вакцины он использовал культуру Y. pestis, инактивированную нагреванием. Были получены замечательные результаты. После этого были вакцинированы миллионы людей, и чума отступила. Однако для Хавкина все закончилось печально. В 1902 году несколько человек умерли от столбняка. Обвинили Хавкина. Скандал носил черты антисемитизма. Его лаборатория в Бомбее осталась без руководителя. Как тут не вспомнить обвинения в адрес Пастера, боровшегося с бешенством. Теперь это далекая история. С тех пор очень многое изменилось. Проводились бесконечные эксперименты, разрабатывались новые, более совершенные вакцины. Однако американцы и во второй половине 20 века прививали своих военнослужащих, воевавших во Вьетнаме, противочумной вакциной (USP), очень похожей на вакцину Хавкина. Различия состояли в том, что бактерий убивали не нагреванием (как Хавкин), а формалином. В нашей стране применяли и применяют другую противочумную вакцину. Это живая вакцина EV. Ее основу составляют бактерии, сохранившие жизнеспособность, но утратившие вирулентность в связи с делецией pgm-области генома. История этой вакцины по-своему интересна. В 1926 году на острове Мадагаскар от бубонной чумы умерла девочка. Из ее трупа был выделен вирулентный штамм Y. рestis, который в течение многих лет многократно пересевали на искусственных питательных средах. Штамм утратил вирулентность. В процессе изучения этих бактерий было установлено, потеря вирулентности связана с делецией участка ДНК, размером 102 тнп, который в норме содержит локус, ответственный за сорбцию гемина (hms), и несколько генов, кодирующих синтез и транспорт сидерофора иерсиниабактина. Эта делеция совсем не случайна и происходит с очень высокой частотой (примерно 10-4– 10-3на клетку). Такая высокая частота связана с тем, что вся область pgm ограничена прямыми повторами инсерционного элемента IS100.
Представленные здесь сведения о возбудителях инфекций свидетельствуют как об их отличиях друг от друга, так и об огромном разнообразии болезней, которые они вызывают. В связи с этим, очевидно, что разработанные вакцины должны применяться по-разному. Некоторые прививки необходимо делать в детском возрасте (например, такие, как против полиомиелита, гепатита В. кори), другие в случае эпидситуации, третьи перед поездкой в эпидемически неблагополучные районы (Африка, Индия).
Материал этой статьи, конечно, не исчерпывает всех имеющихся данных об истории и современном состоянии вакцинологии, но дает представление о сложности возбудителей инфекций и драматизме взаимоотношений в системе паразит-хозяин. Думаю, что этот материал должен также вызвать уважение или даже преклонение перед памятью подвижников, отдавших все силы, а иногда и жизнь делу спасения человечества от инфекционных болезней. Человечество является вакцинозависимой популяцией и для своего благополучия должно продолжать заботиться о разработке новых и совершенствовании имеющихся вакцин.
Для специалистов

